Il microbiota umano ha un ruolo fondamentale nella fisiologia e patologia dell'ospite. L'alterazione microbica intestinale, nota anche come disbiosi, è una condizione associata non solo a disturbi gastrointestinali ma anche a malattie che colpiscono altri organi distali. Recentemente è diventato evidente che i batteri intestinali possono influenzare la fisiologia e l'infiammazione del sistema nervoso centrale (SNC). Il sistema nervoso e il tratto gastrointestinale stanno comunicando attraverso una rete bidirezionale di vie di segnalazione chiamata asse intestino-cervello, che consiste in connessioni multiple, tra cui il nervo vago, il sistema immunitario e metaboliti e prodotti batterici. Durante la disbiosi, queste vie sono disregolate e associate ad alterata permeabilità della barriera ematoencefalica (BBB) e neuroinfiammazione. Tuttavia, numerosi meccanismi alla base dell'impatto del microbiota intestinale nello sviluppo neurologico e nella patogenesi rimangono poco conosciuti. Esistono diverse vie immunitarie coinvolte nell'omeostasi e nell'infiammazione del SNC. Tra questi, la via dell'inflammasoma è stata collegata a condizioni neuroinfiammatorie come la sclerosi multipla, il morbo di Alzheimer e il morbo di Parkinson, ma anche ansia e disturbi simil-depressivi. Il complesso dell'inflammasoma si assembla sull'attivazione cellulare dovuta all'esposizione a microbi, segnali di pericolo o stress e porta alla produzione di citochine pro-infiammatorie (interleuchina-1β e interleuchina-18) e alla pirotosi. Le prove suggeriscono che esiste un'influenza reciproca del microbiota e dell'attivazione dell'inflammasoma nel cervello. Tuttavia, come questa influenza stia funzionando esattamente è ancora da scoprire. Qui, discutiamo lo stato delle conoscenze e le questioni aperte nel campo concentrandoci sulla funzione dei metaboliti o prodotti microbici intestinali sulle cellule del SNC durante condizioni sane e infiammatorie, come la sclerosi multipla, il morbo di Alzheimer e il morbo di Parkinson, e anche i disturbi neuropsichiatrici. In particolare, ci concentriamo sulla via innata dell'inflammasoma come meccanismo immunitario che può essere coinvolto in molte di queste condizioni, dopo l'esposizione a determinati microbi.
Il microbiota intestinale dei mammiferi comprende batteri, virus, funghi, lieviti e batteriofagi. Questa comunità inizia a svilupparsi alla nascita e continua per due-tre anni, nell'uomo, fino a raggiungere una composizione stabile ( 1 ). Tuttavia, continua a essere influenzato da diversi fattori ambientali e di stile di vita nel corso della vita. Pertanto, la composizione del microbiota differisce notevolmente anche tra individui sani ( 2 ). In condizioni sane, il microbiota influenza numerosi processi fisiologici all'interno dell'ospite, come la protezione contro gli agenti patogeni, la digestione e l'assorbimento dei nutrienti, lo sviluppo e l'educazione di più organi dell'ospite e del sistema immunitario ( 3 – 6 ).
Nell'ultimo decennio, diversi studi hanno rivelato forti associazioni tra cambiamenti nella composizione del microbiota (una situazione chiamata “disbiosi”) e varie malattie dell'ospite ( 4 , 5 , 7 ). È interessante notare che, tra queste, ci sono anche malattie che colpiscono gli organi ospiti a distanza fisica dall'intestino ( 8 , 9 ), come il sistema nervoso centrale (SNC) ( 7 , 10 – 22 ). Inoltre, un contributo rilevante del microbiota intestinale non è limitato solo ai disturbi neuroinfiammatori e psichiatrici ( 23 – 32 ) ma anche allo sviluppo cerebrale ( 13 ).
Il SNC è stato a lungo considerato un organo immuno-privilegiato. I vasi sanguigni che vascolarizzano il cervello sono formati da cellule endoteliali tenute saldamente insieme da giunzioni strette che costruiscono la barriera emato-encefalica (BBB). Il BBB consente di regolare rigorosamente i movimenti di molecole, ioni e cellule tra la periferia e il cervello ( 33 ). È importante sottolineare che il BBB protegge il cervello da agenti patogeni e reazioni immunitarie indesiderate che potrebbero danneggiare i neuroni e le loro connessioni ( 34 ). Tuttavia, l'idea che il SNC sia un organo immunitario privilegiato è stata riconsiderata, poiché le cellule immunitarie funzionali possono entrare nel SNC attraverso il BBB, il plesso coroideo e i vasi linfatici e sono state descritte al di là delle condizioni neuropatologiche ( 26 , 35 ).– 47 ). Tra le molecole che possono superare il BBB ci sono anche prodotti batterici e metaboliti che modellano non solo lo sviluppo e le funzioni del SNC ( 6 , 15 ) ma anche la genesi di alcune malattie ( 33 – 42 ).
La comunicazione tra il SNC, l'intestino e il microbiota avviene attraverso il cosiddetto Gut-Brain Axis (GBA), una complessa rete di comunicazione bidirezionale tra l'intestino e il SNC ( 10 , 48 ). Questo asse coinvolge diverse vie come il sistema nervoso autonomo ed enterico, il sistema endocrino, l'asse ipotalamo-ipofisi-surrene (HPA), il sistema immunitario e il microbiota e i suoi metaboliti ( 8 , 31 , 32 ). Diversi neurotrasmettitori ( 11 , 49 ) e metaboliti come vitamine essenziali, acidi biliari secondari, aminoacidi e acidi grassi a catena corta (SCFA) ( 43 , 46 – 51), modulano molte vie del sistema immunitario ( 50 – 56 ) che a loro volta influenzano il comportamento, la memoria, l'apprendimento, la locomozione e i disturbi neurodegenerativi ( 45 , 52 – 55 ). Tra questi percorsi, i ricercatori hanno dimostrato che l'inflammasoma svolge un ruolo nei comportamenti depressivi e ansiosi e nell'attività locomotoria ( 57 ). Un potenziale ruolo della disbiosi è stato suggerito come causa di questi difetti dell'umore e comportamentali ( 55 ), tuttavia, l'esatto meccanismo alla base di questi fenomeni deve ancora essere compreso.
Nonostante le crescenti prove, esiste ancora un significativo divario di conoscenze nella comprensione dei meccanismi esatti coinvolti nella comunicazione tra intestino e cervello durante la salute e la malattia. In questa recensione, forniamo una panoramica dello stato attuale della ricerca sull'effetto del microbiota sul GBA nell'omeostasi e negli stati patologici, con un particolare interesse per i diversi metaboliti batterici coinvolti. Discutiamo ulteriormente il potenziale contributo degli inflammasomi sul GBA, evidenziando le questioni critiche aperte che rimangono sul campo.
Il microbiota è una comunità di microrganismi commensali e simbionti che raggiungono una densità di oltre 10 12 cellule/g di contenuto nell'intestino crasso umano ( 16 ). Da 500 a 1.000 diverse specie batteriche popolano l'intestino dei mammiferi, appartenenti ai quattro phyla batterici dominanti Firmicutes, Bacteroidetes, Actinobacteria e Proteobacteria. Un'interazione benefica ben bilanciata tra l'ospite e il suo microbiota è un requisito essenziale per la salute intestinale e l'organismo nel suo insieme. In condizioni sane, il microbiota della mucosa svolge un ruolo fondamentale nella digestione degli alimenti, nella sintesi vitaminica, nell'angiogenesi, nella maturazione delle cellule epiteliali, nello sviluppo, nell'educazione del sistema immunitario dell'ospite e nella protezione contro i patogeni ( 58 – 66). In particolare, il microbiota orchestra il sistema immunitario locale nell'intestino ( 67 ) e modella le cellule immunitarie e non immunitarie situate nei siti distali e che agiscono a livello sistemico ( 68 , 69 ).
La colonizzazione dell'intestino con una comunità microbica unica inizia alla nascita attraverso l'esposizione del bambino alla microflora del tratto vaginale e alla pelle della madre. Il microbiota si sviluppa e si stabilizza all'età di 2-3 anni negli esseri umani ( 65 ) e entro 3-4 settimane di vita nei topi ( 70 ). Questa prima finestra di vita corrisponde a un periodo in cui diversi organi del corpo attraversano fasi critiche di sviluppo e crescita ( 71). Durante questo periodo, il sistema immunitario del bambino si sviluppa e il microbiota ospite matura e si stabilizza. Il microbiota entra prima in contatto con il sistema immunitario nei siti della mucosa, modellando la tolleranza immunitaria ai microbi commensali e stabilendo allo stesso tempo l'integrità della mucosa. Insieme a questi eventi vengono colpiti anche gli organi distali. Il cervello, in particolare, subisce cambiamenti drammatici all'interno del primo periodo di vita. Entro i primi tre mesi di vita nell'uomo, le sue dimensioni aumentano di oltre il 50% dal momento della nascita, raggiungendo il 90% delle dimensioni dell'organo adulto entro i primi cinque anni di vita ( 72 ). In questo periodo avviene lo sviluppo neuronale ( 73 ) supportato e modellato dal microbiota materno ( 74 – 79).
L'influenza del microbiota intestinale nel neurosviluppo era nota dall'inizio degli anni 2000. I primi esperimenti con topi privi di germi (GF) o privi di patogeni specifici (SPF) trattati con antibiotici, per ridurre la diversità microbica all'interno dell'intestino, hanno mostrato che diversi problemi neurologici si verificano nei topi con ridotto o mancanza di un adeguato microbiota intestinale maturo ( 7 , 10 , 14 , 15 , 34 , 80 , 81 ). In dettaglio, rispetto ai topi colonizzati, i topi GF hanno mostrato un'eccessiva reazione ipotalamo-ipofisi-surrenale (HPA) che limita la reazione allo stress ( 10 ), ha alterato i comportamenti sociali ( 12 , 15 , 82 )), riduzione del comportamento ansioso ( 7 , 81 – 83 ) e aumento dell'attività motoria e di allevamento ( 80 , 84 ). Coerentemente, alcuni sviluppi e comportamenti cerebrali alterati osservati nei topi GF potrebbero essere risolti/migliorati quando gli animali appena nati sono stati ricostituiti con una flora diversa e intatta ( 73 , 82 , 83 ). Il trattamento antibiotico si traduce in una ridotta espressione delle proteine che formano la giunzione stretta, occludina e claudina-5, nel cervello, una maggiore permeabilità al BBB, una riduzione dei comportamenti ansiosi, un comportamento esplorativo elevato e un'attività della gabbia domestica ( 35). Il fenotipo comportamentale alterato era associato a disregolazione di geni e metaboliti noti per essere coinvolti nel controllo motorio e in percorsi comportamentali simili all'ansia, come adrenalina, dopamina, 5-idrossitriptofano (5-HT), proteina della densità postsinaptica 95 (PSD-95), e sinaptofisina ( 80 ).
Ultimamente, sta diventando sempre più evidente che i microbi possono produrre molecole neuroattive che contribuiscono direttamente alla comunicazione tra l'intestino e il cervello ( Figura 1 ). I neurotrasmettitori, come acetilcolina, GABA e serotonina, prodotti da batteri appartenenti alle specie Lactobacillus, Bifidobacteria , Enterococcus e Streptococcus , possono influenzare direttamente e indirettamente la fisiologia delle cellule cerebrali ( 11 , 85 , 86 ). Sorprendentemente, il 90% della serotonina necessaria per l'umore, il comportamento, il sonno e molte altre funzioni all'interno del SNC e del tratto gastrointestinale (GI) viene prodotta nell'intestino ( 87 ).). Il legame della serotonina ai recettori 5-HT sulla microglia induce il rilascio di esosomi portatori di citochine, fornendo un altro meccanismo per la modulazione della neuroinfiammazione indotta dall'intestino ( 88 ). Un altro metabolita microbico che influenza l'attività della microglia è il triptofano, un precursore della serotonina ( 89 ). I metaboliti batterici derivati dal triptofano alimentare potrebbero controllare l'infiammazione del SNC attraverso un meccanismo mediato dal recettore degli idrocarburi arilici (Ahr) che agisce sull'attivazione microgliale e sul programma trascrizionale degli astrociti ( 89). L'importanza del metabolismo del triptofano nel mantenimento dell'omeostasi del SNC era già nota alcuni anni prima, poiché gli animali maschi GF hanno livelli significativamente più elevati di 5-idrossitriptamina e acido 5-idrossiindolacetico nell'ippocampo e nel siero, rispetto agli animali di controllo colonizzati convenzionalmente ( 7 ). . Questi risultati suggeriscono che la circolazione sistemica potrebbe essere la via attraverso la quale il microbiota influenza la neurotrasmissione serotoninergica del SNC. È interessante notare che colonizzare gli animali GF dopo lo svezzamento è stato sufficiente per ripristinare i livelli di triptofano nella periferia e per ridurre l'ansia negli animali GF, ma non è stato sufficiente per invertire le conseguenze neurochimiche del SNC presenti negli animali GF adulti ( 7). Questo approccio ha evidenziato ancora una volta l'importanza di un microbiota intatto e diversificato dalla nascita in poi. Più recentemente, è stato anche riportato che il metabolismo del triptofano da parte della microglia attivata produce la neurotossina acido chinolinico, un agonista N -metil-D-aspartato, implicato in diverse condizioni neurologiche, tra cui la malattia di Huntington e la depressione ( 90 ). Ricolonizzare topi GF con batteri particolari appartenenti alla famiglia dei Clostridia, come Clostridium tyrobutyricum, noto per colonizzare lo strato di muco intestinale, regola l'omeostasi immunitaria e della barriera intestinale attraverso la produzione di metaboliti anti-infiammatori (es. butirrato), induce un aumento dei livelli di occludina e claudina-5 nel cervello dei topi GF e ripristina la loro integrità BBB al livello di topi SPF ( 91 ). Inoltre, integrazioni di probiotici, come Lactobacillus rhamnosus (JB-1), in topi già colonizzati, hanno ridotto il comportamento simile all'ansia e alla depressione in condizioni stazionarie ( 92 , 93). Nel 2019, il gruppo di Artis D. ha dimostrato che i topi SPF trattati con un cocktail di antibiotici ad ampio spettro, i topi GF, i topi GF ricolonizzati dopo lo svezzamento con un microbiota semplice o un microbiota complesso, hanno difetti nell'apprendimento dell'estinzione della paura, rispetto a Topi SPF o topi GF colonizzati con flora SPF al momento della nascita ( 29 ). L'apprendimento dell'estinzione della paura è una reazione che si verifica dopo aver sperimentato un pericolo ambientale ed è stato implicato in molteplici disturbi neuropsichiatrici, inclusi disturbi d'ansia come il disturbo da stress post-traumatico ( 29 ).). Le ragioni di questa risposta comportamentale alterata in assenza di un microbiota diversificato e intatto sono state ricondotte ad alterazioni nelle vie coinvolte nella formazione di sinapsi e nella segnalazione del calcio a livello principalmente di cellule neuronali e microgliali ( 29 ). I ricercatori hanno mostrato che i cambiamenti mediati dal microbiota nella formazione delle sinapsi e nel comportamento di estinzione della paura non erano il risultato dell'asse ipotalamo-ipofisi-surrene ma del livello ridotto di potenziali metaboliti neuroattivi (fenil solfato, pirocatecol solfato, 3-(3-sulfoossifenil )acido propanoico e solfato indossale) nel liquido cerebrospinale, nel siero e nei campioni fecali di topi GF rispetto ai topi SPF ( 29 ). Tuttavia, i tipi di cellule (ospite o batteriche) che producono questi metaboliti sono ancora da scoprire.
Figura 1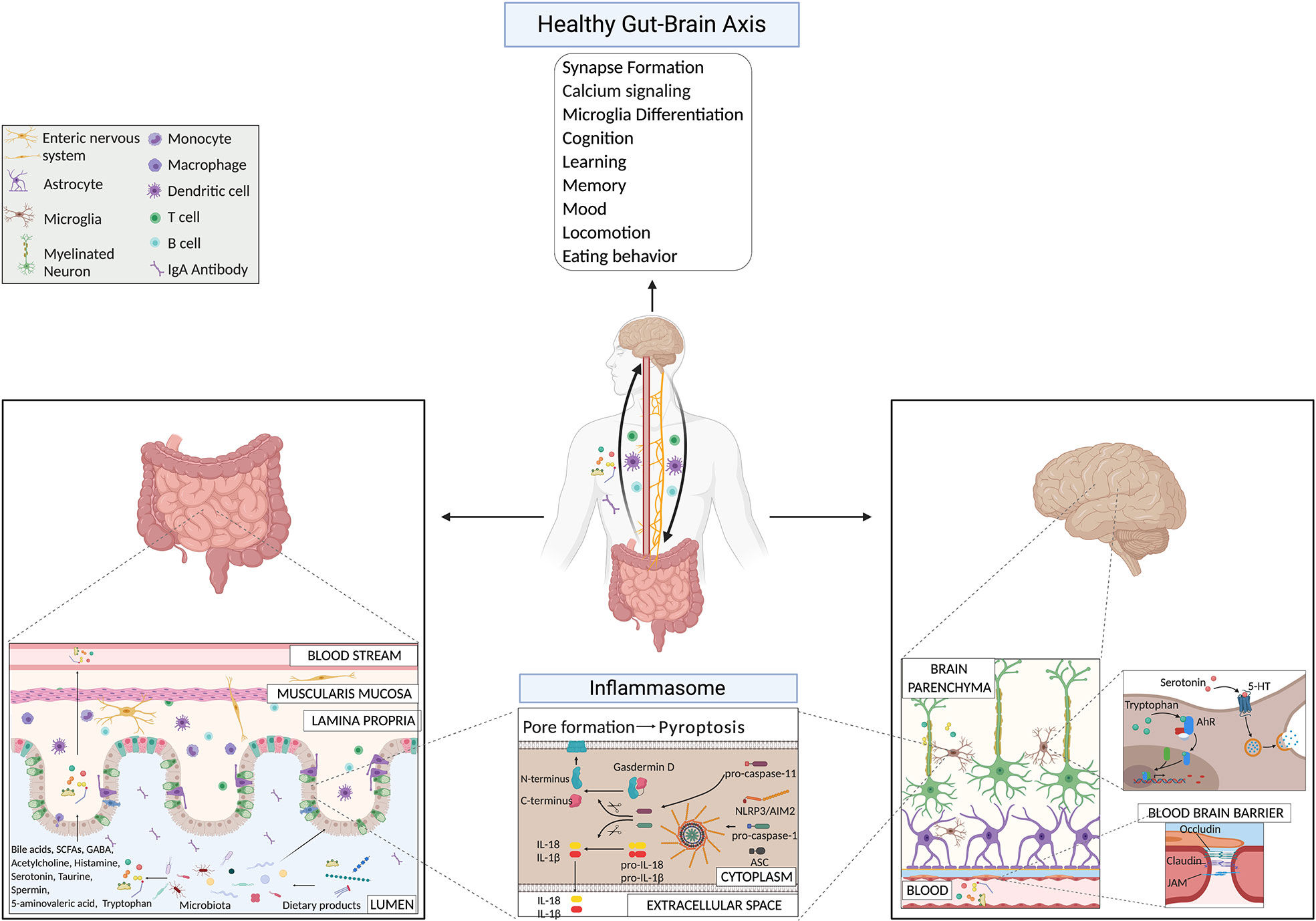
FIGURA 1 Meccanismi dell'asse intestino-cervello in condizioni fisiologiche che evidenziano i prodotti microbici e la via dell'inflammasoma.
Da un punto di vista immunologico e metabolomico, i topi GF, SPF trattati con antibiotici, o topi gnotobiotici con limitata diversità del microbioma (colonizzati con ASF per esempio) hanno mostrato una maturazione della microglia e una risposta immunitaria alterata agli stimoli batterici, rispetto ai topi SPF ( 94 ). Inoltre, il trattamento di topi con E. coli , isolati da topi colitici, ha causato colite e compromissione della memoria cerebrale ( 95 , 96 ). Al contrario, il trattamento con L. johnsonii ha ripristinato una sana composizione del microbiota intestinale e ha attenuato sia la colite che il deterioramento della memoria indotto da E. coli ( 95 , 96). Inoltre, la fermentazione batterica delle fibre alimentari indigeribili produce tra gli SCFA, butirrato, propionato e acetato nel colon ( 97 ). Gli SCFA mantengono la salute dell'intestino promuovendo l'integrità della barriera intestinale, la produzione di muco e supportando una risposta tollerogenica sull'infiammazione ( 49 , 50 , 98 , 99 ). Tuttavia, la loro attività non è limitata solo all'intestino. Una piccola frazione raggiunge la circolazione sistemica e può attraversare il BBB strettamente regolato utilizzando i propri trasportatori situati sulle cellule epiteliali vascolari cerebrali ( 100 , 101 ). Gli SCFA sono, infatti, rilevabili in basse quantità nel cervello umano in condizioni fisiologiche ( 102). Inoltre, influiscono anche sulla BBB stessa; la colonizzazione di topi adulti GF con un microbiota complesso o solo con ceppi batterici produttori di SCFA ripristina l'integrità del BBB ( 91 ). Sorprendentemente, il trattamento di topi GF con l'applicazione orale di una miscela dei tre principali SCFA acetato, propionato e butirrato, è stato anche sufficiente per ripristinare il normale processo di maturazione della microglia ( 94 ). Inoltre, gli SCFA possono modulare neurotrasmettitori, come glutammato, glutammina, GABA e fattori neurotrofici ( 103 ). Il propionato e il butirrato possono influenzare il sistema di segnalazione cellulare modificando i livelli intracellulari di potassio ( 104), e regolano i livelli di espressione della triptofano 5-idrossilasi 1, coinvolta nella sintesi della serotonina, e della tirosina idrossilasi, che è coinvolta nella biosintesi di dopamina, adrenalina e noradrenalina ( 105 ).
Diverse altre vie immunitarie hanno dimostrato di influenzare il comportamento, la memoria, l'apprendimento e la locomozione ( 41 , 57 , 106-108 ) . Tra questi, discuteremo più dettagliatamente in seguito il ruolo della via dell'inflammasoma nel GBA.
Diversi fattori ambientali poco conosciuti, inclusi fattori dietetici e legati alle abitudini, sono stati collegati alla suscettibilità ai disturbi neurologici e alle alterazioni del microbiota intestinale ( 30 , 109 , 110 ). La composizione del microbiota differisce significativamente tra controlli sani e pazienti affetti da malattie neurodegenerative (come sclerosi multipla (SM), Alzheimer (AD) e Parkinson (PD)) ( 20 , 22 , 23 , 32 , 111 – 115 ) e neuropsichiatrici disturbi (SNP) ( 30), come i disturbi depressivi maggiori e dell'umore. Di estrema rilevanza, il microbiota alterato dei pazienti potrebbe trasferire la malattia da un ospite umano a un ospite di topo ( 113 , 116 – 120 ). Qui presentiamo i meccanismi guidati dai batteri che inducono diverse malattie neurologiche ( Figura 2 ). Siamo alle fasi iniziali di questo percorso di scoperta, e per la maggior parte delle condizioni patologiche, non sappiamo ancora se la disbiosi ne sia la causa o meglio la conseguenza. Qui, concentriamo la nostra attenzione sui lavori che hanno suggerito i meccanismi d'azione dei batteri nell'eziologia di alcuni disturbi del SNC.
Figura 2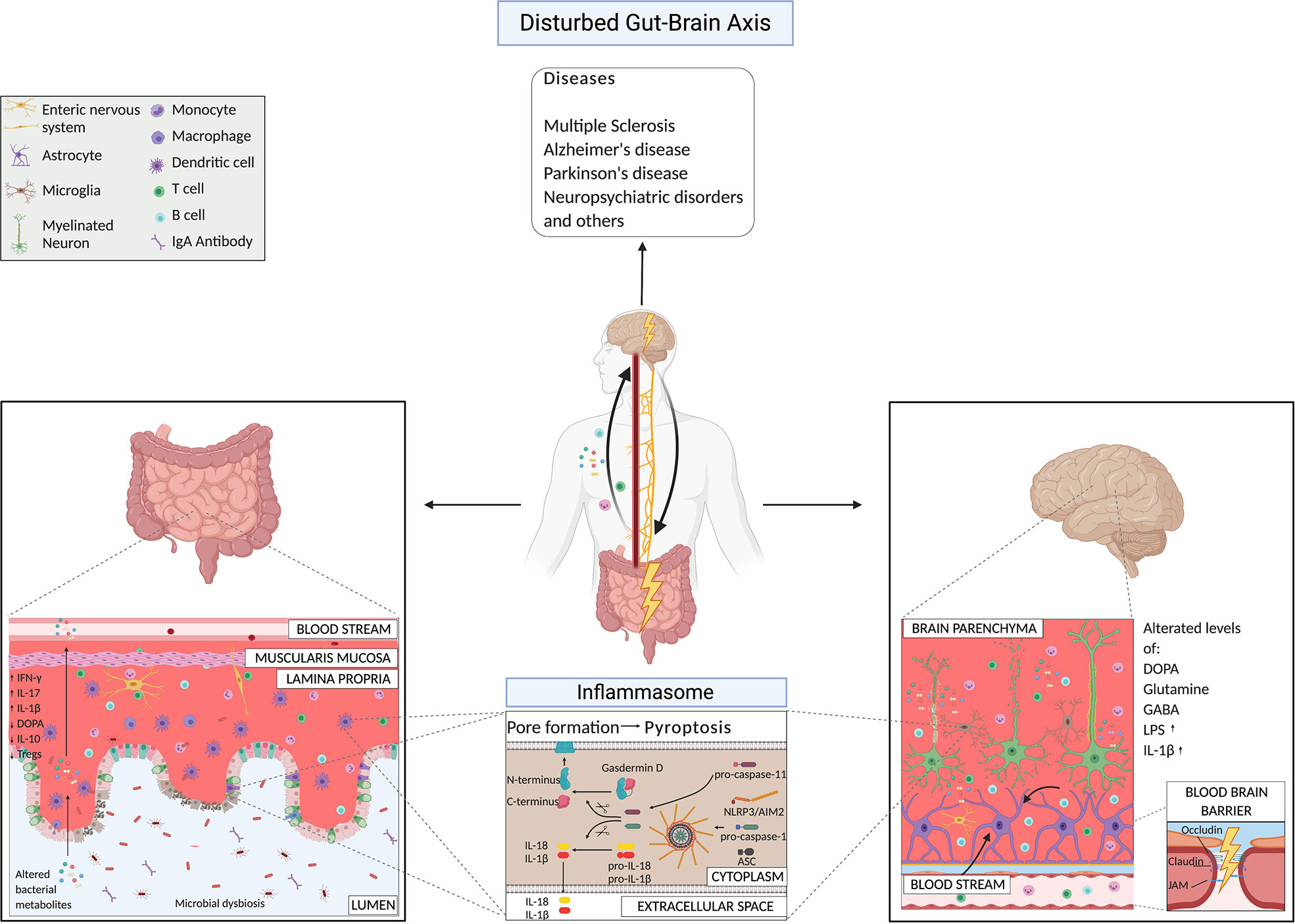
FIGURA 2 Meccanismi dell'asse intestino-cervello in condizioni patologiche che evidenziano i prodotti microbici e la via dell'inflammasoma.
La sclerosi multipla (SM) è una malattia autoimmune e neurodegenerativa che colpisce più di due milioni di persone in tutto il mondo. Questa condizione è caratterizzata da neuroinfiammazione, infiltrazione di linfociti nel SNC, demielinizzazione e perdita assonale. I segni clinici associati alla SM comprendono atassia, perdita di coordinazione, iperreflessia, spasticità, deterioramento visivo e sensoriale, affaticamento e difficoltà cognitive. La maggior parte dei pazienti presenta una forma recidivante-remittente della malattia, caratterizzata da una progressiva ricaduta dei sintomi con un aumento nel tempo di un grave deterioramento neurologico ( 121 ). La maggior parte dei pazienti sviluppa lesioni nel cervello o sia nel cervello che nel midollo spinale, sebbene pochi sviluppino lesioni solo nel midollo spinale ( 121). La SM è la causa di morte in oltre il 50% dei pazienti affetti ( 122 ). I fattori coinvolti nella patogenesi sono sia ambientali che genetici ( 123 – 131 ). Tra i fattori ambientali, i microbi (ei loro prodotti secreti o tossine) svolgono un ruolo critico nella patogenesi della SM ( 132 , 133 ). Diversi importanti studi pionieristici hanno dimostrato che le infezioni microbiche esterne e i batteri commensali intestinali possono essere coinvolti nello sviluppo della malattia.
Innanzitutto, la composizione del microbiota dei pazienti con SM è diversa da quella degli individui sani ( 104 ). È interessante notare che anche i pazienti con SM con malattia attiva hanno un microbiota alterato rispetto ai pazienti in fase di remissione, che a loro volta hanno un microbiota più simile ai controlli sani ( 25 , 134 – 138 ). I batteri appartenenti alla famiglia dei Clostridi contribuiscono alla soppressione dell'autoimmunità patologica ( 134 , 139 – 143 ). Una maggiore abbondanza di Firmicutes e l'assenza di Fusobacteria erano associate a un tempo più breve alla ricaduta nei pazienti pediatrici con SM ( 144). Inoltre, i pazienti con SM trattati con l'antibiotico minociclina, una tetraciclina ad ampio spettro, hanno ridotto il tasso di recidive e il miglioramento di diversi parametri immunologici (come IL-12p40, metalloproteinasi-9 e molecola di adesione delle cellule vascolari solubili-1) ( 145 , 146 ). Tuttavia, l'effetto della minociclina sulla composizione del microbiota del paziente non è stato affrontato. In un ulteriore studio rilevante, tre pazienti con SM sono stati sottoposti a trapianti multipli di microbiota fecale (FMT) per trattare la stitichezza grave. Questo trattamento ha ripristinato la malattia intestinale e migliorato i sintomi della SM ( 147), dimostrando l'esistenza di una connessione intestino-cervello. Inoltre, i supplementi di probiotici hanno un potenziale terapeutico per migliorare la SM, migliorando lo stato di disabilità, la salute mentale e alcuni parametri infiammatori e metabolici, rispetto al gruppo placebo ( 148 , 149 ). Lo studio fondamentale di Berer K. e colleghi ha evidenziato il forte impatto immunologico in vivo del microbiota sulla patogenesi della SM ( 112 ). Hanno reclutato una coorte di coppie gemelle monozigoti in cui un individuo era affetto da SM e l'altro gemello era sano ( 112 ). Hanno riferito che i gemelli MS avevano una maggiore abbondanza di taxa come l' Akkermansia nelle loro feci ( 112). Tuttavia, la notevole scoperta è stata che il trapianto dei microbi intestinali dei gemelli MS in animali GF, geneticamente suscettibili allo sviluppo di encefalomielite autoimmune sperimentale (EAE) è stato sufficiente per promuovere la malattia in vivo con un'incidenza significativamente maggiore rispetto al trapianto dei microbi dei gemelli sani ( 112 ). È interessante notare che le cellule immunitarie dei riceventi murini di campioni derivati dalla SM hanno prodotto meno IL-10 rispetto alle cellule di topi colonizzati con il microbiota derivato dai gemelli sani ( 112 ). IL-10 è una delle principali citochine regolatrici e la sua neutralizzazione nei topi colonizzati con campioni fecali sani ha aumentato l'incidenza della malattia ( 112). Questa significativa scoperta ha evidenziato il potenziale del microbiota umano di indurre specifiche alterazioni del sistema immunitario che potrebbero essere la causa o l'effetto dello sviluppo della SM. Tuttavia, i meccanismi esatti che sopprimono la produzione di citochine regolatrici negli ospiti che ricevono determinati microbi dai pazienti con SM non sono ancora chiari. Diverse ricerche sugli animali hanno iniziato a chiarire questi meccanismi. Il gruppo di Kasper L. ha mostrato che il trattamento orale ma non sistemico con un pool classico di antibiotici ad ampio spettro (ampicillina, vancomicina, neomicina e metronidazolo) ha migliorato lo sviluppo di EAE acuto, in due modelli murini (su C57BL/6 e SJL sfondi) ( 18). Il miglior esito della malattia dopo il trattamento antibiotico orale è stato associato a una riduzione delle citochine pro-infiammatorie e ad un aumento delle citochine regolatrici come l'IL-10 ( 18 ). Questo effetto ha suggerito che il microbiota intestinale fosse responsabile della gravità della malattia e della modulazione della risposta immunitaria adattativa durante lo sviluppo della malattia ( 18 ).
Un anno dopo, lo stesso laboratorio ha mostrato come un singolo batterio potrebbe influenzare la patogenesi dell'EAE. Hanno utilizzato un approccio simile nei topi esaurendo i batteri intestinali tramite un trattamento antibiotico orale seguito dalla ricostituzione solo con B. fragilis , wild-type (WT) o carente per la produzione del polisaccaride capsulare zwitterionico A (ΔPSA) ( 116 ) . I topi trattati con antibiotici da soli o ricolonizzati con il ceppo PSA-wild-type di B. fragilis sono stati protetti contro la malattia, mentre i topi ricolonizzati con ΔPSA B. fragilis e anche il gruppo di controllo trattato con il veicolo hanno sviluppato la malattia ( 116 ). Gli autori hanno anche capito che B. fragilisprotezione EAE indotta attraverso la generazione di cellule T regolatorie (Treg) produttrici di IL-10 in modo PSA-dipendente ( 20 ). Hanno quindi concluso che il trattamento orale con PSA potrebbe causare protezione dall'EAE nei topi, se utilizzato sia come approccio profilattico che terapeutico, tramite il reclutamento di cellule CD103 + CD11c ad alto contenuto di antigene e l'adescamento di cellule Treg che producono IL-10 nella linfa cervicale -nodi ( 150 ). Successivamente, Lee Y. e colleghi hanno mostrato per la prima volta che i topi GF erano quasi completamente protetti dall'EAE rispetto ai topi colonizzati convenzionalmente ( 117 ).). Anche in questo caso, la protezione è stata associata a una diminuzione dei livelli di citochine pro-infiammatorie, come IFN-γ e IL-17A, e un aumento delle cellule Treg negli organi periferici, nell'intestino e nel midollo spinale ( 117 ). Sorprendentemente, i topi GF colonizzati con un solo batterio, l'SFB, hanno sviluppato EAE e una risposta immunitaria patogena T helper (Th)-17 nell'intestino e nel SNC ( 117 ).
Nel recente studio fondamentale dei gruppi di Gommerman J. e Baranzini SE., è stato suggerito che le plasmacellule produttrici di IL-10 e IgA abbiano un ruolo nel miglioramento dell'EAE nei topi e siano correlate con la ricaduta nei pazienti con SM ( 151 ) . È stato dimostrato che cellule secernenti IgA microbiche specifiche sono presenti sia nel midollo osseo che, in particolare, nel cervello dei topi affetti da EAE, ma non negli animali sani. Sorprendentemente, i pazienti con SM durante la recidiva attiva avevano meno IgA specifiche per i batteri intestinali rispetto ai pazienti in remissione, suggerendo la capacità delle cellule produttrici di IgA di migrare dall'intestino al sistema nervoso centrale durante le recidive della malattia, come nel sistema murino ( 151 ).). Gli autori hanno anche escluso uno dei potenziali meccanismi mediati dalle plasmacellule che secernono IgA per sopprimere l'EAE. In breve, le cellule produttrici di IgA reattive al commensale esprimevano IL-10 e la produzione di IL-10 (parzialmente insieme a iNOS, ma non IgA stessa) era essenziale per migliorare l'EAE ( 151 ). Ultimamente, nel modello classico di EAE acuto, la sola somministrazione di ampicillina ha migliorato lo sviluppo di EAE ( 152 ) con una riduzione dei linfociti T autoreattivi CD4 + proliferanti. Miyauchi E. e colleghi hanno dimostrato che il trattamento in vivo con ampicillina ha indotto il completo esaurimento dell'allobaculumbatteri dell'intestino tenue. La monocolonizzazione con questo batterio ha indotto la generazione di cellule Th17 nella lamina propria dell'intestino tenue e a livello sistemico e ha aumentato la gravità dell'EAE, rispetto ai topi GF ( 152 ). Tuttavia, lo sviluppo della malattia è stato meno grave rispetto alle condizioni igieniche convenzionali. Gli autori hanno quindi concentrato la loro attenzione sui batteri che si localizzano nell'intestino tenue e che potrebbero favorire la generazione e la proliferazione di cellule T autoreattive attraverso la presentazione di antigeni cross-reattivi. I topi portatori di un recettore delle cellule T (TCR) specifico per la glicoproteina mielina-oligodendrocitaria (MOG) (topi 2D2) hanno mostrato un numero maggiore di cellule T CD4 + nella lamina propria dell'intestino tenue rispetto alla loro controparte wild-type ( 152). Alcuni peptidi mimetici candidati, come la proteina del sistema UvrABC A (UvrA), sono stati espressi da L. reuteri e l'amminopeptidasi da ceppi di Allobaculum ( 152 ). È interessante notare che la monocolonizzazione di L. reuteri non ha influenzato la gravità dell'EAE. Tuttavia, la bicolonizzazione con Allobaculum e L. reuteri ha attivato insieme le cellule T MOG-specifiche verso un fenotipo patogeno Th17 e ha peggiorato l'EAE, con demielinizzazione e infiltrazione cellulare nel midollo spinale ( 152). Questo studio ha messo in evidenza l'importante potenziale sinergico di diversi batteri intestinali, lungo l'intero tratto intestinale e forse residenti anche a stretto contatto con lo strato di muco, nel mediare lo sviluppo della malattia attraverso il mimetismo molecolare.
Complessivamente, questi studi rivoluzionari sui muri dimostrano che alcune specie batteriche intestinali influenzano profondamente la patogenesi dell'EAE, alterando l'equilibrio tra le risposte immunitarie pro e antinfiammatorie attraverso un effetto diretto di alcuni prodotti batterici. Il trattamento di topi che sviluppano spontaneamente EAE con un cocktail di antibiotici ad ampio spettro ha portato a risultati notevolmente diversi, a seconda che gli antibiotici fossero stati somministrati prima o dopo l'insorgenza della malattia autoimmune. Il trattamento profilattico antibiotico (a 1-3 settimane prima dell'esordio clinico della malattia, a partire da 2-4 settimane di età) ha portato a una significativa riduzione della suscettibilità all'EAE spontanea, accompagnata da un'alterata composizione microbica intestinale e una diminuzione di Th-17 sviluppo cellulare ( 153). Al contrario, il trattamento antibiotico dopo l'esordio dei primi segni di EAE spontaneo non ha influenzato la malattia in corso e l'infiammazione del SNC ( 153 ). L'integrazione di un cocktail di cinque probiotici (IRT5) prima o dopo l'insorgenza dell'EAE nei roditori è associata rispettivamente al ritardo dell'insorgenza della malattia o alla soppressione della progressione della malattia ( 154 ). Il miglioramento della malattia in seguito al trattamento con probiotici era associato a una maggiore abbondanza di cellule Treg, a una maggiore produzione di IL-10 da parte dei linfociti T CD4 + , dei linfociti B e dei linfociti CD11c + , insieme alla soppressione del pro-infiammatorio Th-1 /Gio-17 risposta ( 154). Questi risultati suggeriscono che la modulazione del microbiota nelle prime fasi della vita o i trattamenti profilattici in soggetti che sono geneticamente inclini a sviluppare determinate malattie autoimmuni, come la SM, potrebbero essere approcci efficienti per migliorare la suscettibilità alla malattia e/o per ritardare l'insorgenza della malattia. In particolare, solo alcuni batteri con specifiche caratteristiche metaboliche o strutturali sembrano efficaci nel prevenire o posticipare l'insorgenza di determinate condizioni. Ad esempio, la somministrazione orale di SCFA migliora lo sviluppo di EAE e la gravità della malattia ( 155 , 156 ). Meccanicamente, gli SCFA favoriscono il potenziamento del metabolismo dell'acetil-CoA, l'acetilazione dell'istone, la conservazione del contenuto lipidico del midollo spinale, la soppressione della demielinizzazione, la maturazione e la differenziazione degli oligodendrociti ( 157, 158 ). Come accennato in precedenza, negli ultimi anni, il gruppo di Quintana F. ha fornito un contributo eccezionale al campo, rivelando il ruolo del metabolismo del triptofano alimentare (Trp) nella patogenesi della SM ( 118 ). Il microbiota intestinale metabolizza il triptofano alimentare in agonisti di AhR ( 119 ). In primo luogo, hanno dimostrato che il trattamento dei topi con antibiotici o l'alimentazione con una dieta carente di Trp durante la fase di recupero del modello EAE ha peggiorato i punteggi EAE ( 118 ). Tuttavia, la malattia è stata migliorata con l'integrazione di metaboliti del Trp (come indolo, indossil-3-solfato (I3S), acido indolo-3-propionico (IPA) e indolo-3-aldeide (IAld)) o alimentando con una dieta arricchita con Trp ( 118). Hanno anche scoperto che nei pazienti affetti da SM, i livelli circolanti di agonisti AhR sono diminuiti. In conclusione, hanno suggerito una modalità d'azione degli agonisti dell'Ahr, attraverso un effetto diretto sugli astrociti per limitare l'infiammazione del SNC durante l'EAE ( 118 ). Un paio di anni dopo, lo stesso gruppo ha scoperto che la microglia ha un ruolo cruciale in questo meccanismo di protezione dall'EAE attraverso il percorso Trp-AhR ( 89 ). In breve, il trattamento con Trp o I3S ha migliorato i punteggi EAE nei topi di controllo ma non nei topi privi di espressione di AhR sulla microglia alimentata con una dieta carente di Trp ( 89 ). Questo trattamento è stato iniziato 14 giorni dopo l'induzione dell'EAE e ha migliorato la malattia tramiteCoinvolgimento di AhR su astrociti e microglia ( 89 ). Inoltre, utilizzando la microglia umana primaria, hanno dimostrato che la stimolazione in vitro con I3S ha attivato la via di segnalazione AhR portando alla soppressione delle vie pro-infiammatorie (tramite l'espressione di TNF-α, IL-6, IL-12A, NOS2, VEGF-β ), e la promozione di risposte antinfiammatorie (come l'espressione di IL-10 e TGF-α) ( 89 ). Infine, hanno rilevato l'espressione di AhR, TGF-α e VEGF-β sulle cellule mieloidi CD14 + nelle lesioni demielinizzate della SM attiva e cronica dei pazienti ( 89). Questi risultati suggeriscono che i metaboliti derivati dalla digestione del triptofano da parte della flora intestinale attivano la segnalazione AhR negli astrociti e nella microglia e inducono meccanismi di protezione immunitaria nell'ospite che sono importanti per sopprimere l'infiammazione del SNC, in entrambi i modelli animali e forse anche nei pazienti umani. Complessivamente, questi lavori suggeriscono l'efficacia di diversi interventi volti a modificare la composizione del microbiota come approcci profilattici o terapeutici. Pertanto, la necessità di studi che aiutino a comprendere il meccanismo d'azione di diversi metodi microbici in diversi pazienti, portatori di un microbiota diverso, diventa una priorità per la ricerca futura nel campo.
Il morbo di Alzheimer (AD) è la causa più comune di demenza progressiva che colpisce quasi 50 milioni di persone in tutto il mondo. I sintomi che colpiscono la memoria e il pensiero diventano, con il tempo, gravemente gravi, compromettendo anche i più semplici compiti della vita quotidiana. Fino ad oggi non esiste una strategia terapeutica né profilattica contro questo devastante disturbo neurodegenerativo ( 159 ). L'AD è causata dalla formazione di aggregati di forme polimerizzate della proteina precursore β-amiloide (Aβ) in depositi multimerici solubili e/o amiloide insolubili nel cervello, che innescano una cascata di eventi patologici che portano a grovigli neurofibrillari, aggregati di proteine tau iperfosforilate , formazione di lesioni neurofibrillari e infine demenza ( 159). Diversi fattori microbici sono stati collegati alla patogenesi dell'AD ( 140 , 141 ) e alcuni studi hanno suggerito l'alterazione del microbiota commensale e le infezioni patogene come potenziali cause dell'AD ( 142 ).
Il profilo microbico delle feci dei pazienti con AD mostra un numero ridotto di Firmicutes e Actinobacteria e un aumento dei Bacteroidetes rispetto ai controlli. All'interno dei Firmicutes, le famiglie Ruminococcaceae , Turicibacteraceae e Clostridiaceae erano tutte meno abbondanti nei pazienti con AD ( 160 ).
I doppi topi transgenici APP/PS1, che esprimono neuroni speciali nel SNC con un topo chimerico/proteina precursore dell'amiloide umana (APP) e una presenilina 1 umana mutante (PS1), mostrano un notevole cambiamento nella composizione del microbiota intestinale rispetto ai topi selvatici sani tipo topi ( 161 ). Meno Firmicutes ( Akkermansia e Rikenellaceaea ) ma più Bacteroidetes (S24-7) sono stati identificati in topi APP/PS1 allevati convenzionalmente rispetto ai controlli della cucciolata di tipo selvatico ( 161 ). È importante sottolineare che i topi transgenici GF-APP/PS1 hanno livelli di Aβ ridotti nel cervello e nel sangue e un carico di amiloide ridotto rispetto ai topi APP/PS1 allevati convenzionalmente ( 161). Il trapianto fecale da topi APP/PS1 allevati convenzionalmente in ospiti GF APP/PS1 ha aumentato notevolmente la patologia cerebrale Aβ negli ospiti ( 161 ). Complessivamente, questi risultati hanno fortemente supportato un coinvolgimento del microbiota nello sviluppo dell'AD in modelli animali suscettibili all'AD ( 161 ). Inoltre, i topi 5xFAD (che sovraesprimono nel cervello l'APP umana mutante che porta mutazioni della malattia di Alzheimer familiare (FAD) di Svezia, Florida e Londra insieme a PS1 umana che ospita due mutazioni di FAD) ricapitolano caratteristiche significative della composizione microbica dell'AD e della composizione microbica fecale che si evolvono con l'età ( 162 , 163). All'età di due-tre mesi, quando inizia la deposizione di placca Aβ nella corteccia e nell'ippocampo, Bacteroides, Firmicutes e Verrucomicrobia erano i phyla batterici più abbondanti ( 163 ). All'età di sette mesi, quando compaiono i segni della degenerazione sinaptica, Firmicutes diventa il phylum predominante, con una marcata diminuzione dell'abbondanza di Bacteroidetes e Verrucomicrobia. Queste variazioni nel tempo erano assenti nei topi wild-type, che avevano un microbiota molto più stabile per tutta la durata della vita ( 163). Questi cambiamenti nella composizione del microbiota erano associati a marcatori neuroinfiammatori. Infatti, a 2-3 mesi di età, la microglia sia pro-infiammatoria che antinfiammatoria si è espansa, mentre nei mesi successivi solo il primo sottogruppo ha continuato a crescere, insieme al reclutamento di Th-1 CD4 +cellule proinfiammatorie, raggiungendo un picco a sette-nove mesi. D'altra parte, la microglia antinfiammatoria è diminuita da tre a cinque mesi e successivamente si è mantenuta a livelli bassi. È importante sottolineare che questa è stata la prima volta che i cambiamenti nella composizione del microbiota sono stati monitorati durante lo sviluppo di una malattia neurologica, suggerendo che i cambiamenti batterici potrebbero verificarsi insieme o prima dei cambiamenti immunologici e neurologici. Le modificazioni neuroinfiammatorie erano, infatti, sorprendentemente dipendenti da quelle del microbiota e l'esaurimento dei microbi intestinali tramite il trattamento antibiotico migliorava il reclutamento e l'innesco della microglia antinfiammatoria e delle cellule Th-1 ( 163). Esperimenti di co-housing o FMT hanno mostrato che la neuroinfiammazione e i disturbi cognitivi potrebbero essere trasferiti da topi 5xFAD a controparti wild-type ( 163 ). L'uso di un oligomannato di sodio, con noto effetto di miglioramento della cognizione nell'uomo, ha soppresso la neuroinfiammazione, la deposizione di placca Aβ e il deterioramento della cognizione ( 164 ). Tuttavia, dal punto di vista del microbiota, il risultato più sorprendente di questo approccio terapeutico deriva dagli esperimenti FMT da topi 5xFAD trattati con oligomannato in host WT che sono stati pretrattati con iniezioni di aggregati di Aβ per indurre lo sviluppo di AD ( 163 ). Le feci isolate da topi 5xFAD trattati con oligomannato hanno trasferito la protezione da eventi neuroinfiammatori negli animali riceventi ( 163). Le analisi metaboliche sulle feci di questi animali hanno rivelato cambiamenti significativi nel metabolismo correlato agli aminoacidi, in particolare per le vie correlate alla fenilalanina e all'isoleucina. La fenilalanina e l'isoleucina possono essere assorbite dalle cellule immunitarie adattative, come le cellule Th-1 ( 163 ). Inoltre, la diversità del microbiota intestinale è stata alterata e i livelli di SCFA sono stati ridotti nei topi AD rispetto ai topi di controllo di tipo selvaggio. Pertanto, le modificazioni della flora intestinale influiscono su diverse vie metaboliche nei modelli murini di AD, che potrebbero portare a difetti cognitivi, deposizione di amiloide e anomalie intestinali ( 165 ). Allo stesso modo, un recente lavoro ha mostrato che i topi ADLP APT presentano alterazioni a livello di comunità nel microbiota rispetto agli animali selvatici (166 ). I topi ADLP APT sono portatori di sei mutazioni umane che colpiscono la proteina precursore dell'amiloide, la presenilina-1 e la proteina tau e sviluppano una patologia simile all'AD con grovigli amiloide e neurofibrillare ( 167 ). In seguito a trapianti microbici fecali da animali WT in topi ADLP APT , la formazione di placche β amiloidi e grovigli neurofibrillari, la reattività gliale e il deterioramento cognitivo sono stati migliorati nei topi riceventi ( 166 ). Insieme, questi risultati evidenziano il ruolo dei microbi intestinali nella promozione della neuroinfiammazione nella progressione dell'AD attraverso l'alterazione delle vie metaboliche e immunologiche.
La supplementazione di probiotici è stata presa in considerazione anche per l'AD ( 168 , 169 ). L'isolato umano Bifidobacterium longum (NK46) è stato somministrato per via orale in topi 5xFAD e ha indotto effetti antinfiammatori (diminuzione dei livelli di lipopolisaccaridi (LPS), attivazione di NF-κB ed espressione di TNF-α), cambiamenti nella composizione del microbiota intestinale dei riceventi (aumento di Bacteroides e riduzione di Firmicutes e Proteobacteria phyla) e soppressione dell'accumulo di Aβ nell'ippocampo ( 170 ).
Per concludere, nell'eziologia dell'AD è stato chiarito un ruolo intrigante e rilevante del patogeno orale Porphyromonas gingivalis , l'agente che causa la parodontite cronica ( 120 ). Riteniamo che i meccanismi adottati da questo batterio potrebbero essere rilevanti da studiare in quanto anche alcuni commensali potrebbero avere una modalità d'azione simile. Dominio SS. e colleghi hanno identificato Porphyromonas gingivalis e le gingipains, le proteasi tossiche prodotte da questo batterio, nel cervello dei pazienti con AD ma non nel cervello dei pazienti di controllo senza storia di anomalie o condizioni neurologiche ( 120 ). Gengipaine co-localizzate con neuroni e astrociti e anche grovigli tau e Aβ intraneuronale nel tessuto dei pazienti con AD ( 120). P. gingivalis 16S rRNA è stato rilevato sia nel liquido cerebrospinale che nella corteccia cerebrale di pazienti con AD ( 120 ). L'infezione orale da P. gingivalis nei topi che non sono geneticamente suscettibili allo sviluppo di AD ha portato alla rileva
OMNITRON-PRO ITALIA S.R.L. | P.IVA 04683930277 | info@omnitron-pro.it